
10月24号,美国Gladstone HIV治疗研究中心、加利福尼亚大学、Xyphos生物科技公司的相关研究人员在Cell杂志上发表了一篇名为《利用convertibleCAR-T细胞(高度适应的杀伤平台)攻击潜在的HIV病毒》(Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform )的文章。
看完这个题目,相信不少人的表情都是这样的:

别急,为了保证大家都能看懂,咱们先从几个基础概念说起~
基本概念
1、“HIV病毒库”
所谓的“HIV病毒库”是指体内一组被HIV感染的特殊的免疫细胞,特别之处在于虽然被感染,但他们处于休眠(或者说潜伏)状态,不会产生新的HIV病毒。HIV病毒可以在这些细胞内隐藏数年,且随时可以激活复制更多的病毒。这也是鸡尾酒疗法不能根治HIV的原因之一。
2、CAR-T细胞
在以前的一篇文章里(Science子刊:治疗新思路,用癌症治疗方法治疗HIV)咱们也写过CAR-T细胞就是一种经过经嵌合抗原受体修饰的T细胞,特殊之处在于在维持自身免疫杀伤作用的同时能通过嵌合的抗体特异性地识别靶细胞进行有针对性的高效攻击。
但是,既往的研究中CAR-T有明显的缺点:
❒a.每次进行不同疾病的治疗都要重新设计一种特异性的CAR-T细胞;
❒b.CAR-T治疗启动后就一直处于“开启”状态,没法从外界控制。
3、Convertible CAR-T
为了弥补上述两个缺点,研究人员设计出了一种新型的CAR-T方案。
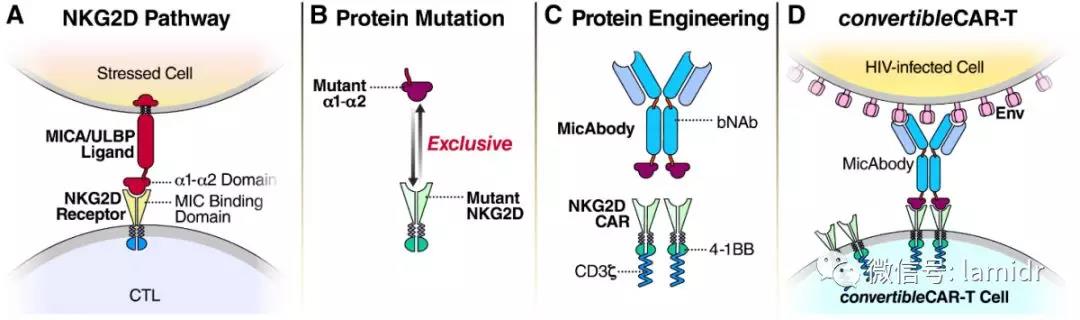
Convertible CAR-T细胞的合成思路
(A)NK细胞和细胞毒性T淋巴细胞(CTL)细胞应激时会天然表达一种NKG2D受体,可以与MICA/ULBP配体通过α1-α2结构天然结合。
(B)通过蛋白质工程,创建突变的α1-α2结构和突变的NKG2D受体,他们可以特异性结合。
(C)将bNAb和α1-α2结构连接形成的结构称为MicAbody。而CAR-T细胞表面的结构为NKG2D+4-1BB+CD3ξ。
(D)此时的CAR-T细胞称为convertible CAR-T细胞,可以通过MicAbody特异性结合被HIV感染的细胞。
简而言之,就是改造出一种能表达突变NKG2D受体的细胞,并通过MicAbody这个“桥梁”特异性识别体内被HIV感染的细胞。
优点是新的convertible CAR-T细胞可以通过控制“桥梁”MicAbody的量使反应得到人为控制,也可以通过改造MicAbody用于新的疾病。
研究结果
介绍了这么久,那效果如何呢?
//特异性杀伤HIV感染的原代CD4+ T淋巴细胞//

基于淋巴组织的杀伤试验
研究人员选取了HIV储存库常见部位的扁桃体/脾脏组织细胞转染HIV-GFP(GFP为一种标记物)。将转染后的细胞与cCAR-T细胞和MicAbody联合培养,通过测定活性CD3+/CD8-GFP细胞数量,测定其毒性和潜在杀伤作用。
研究结果表明,cCAR-T细胞平台能够识别并有效杀灭感染是掩饰适应型和t/f型HIV病毒的原代细胞,且微量MicAbody浓度足以触发cCAR-T细胞平台对感染细胞的强烈杀伤。
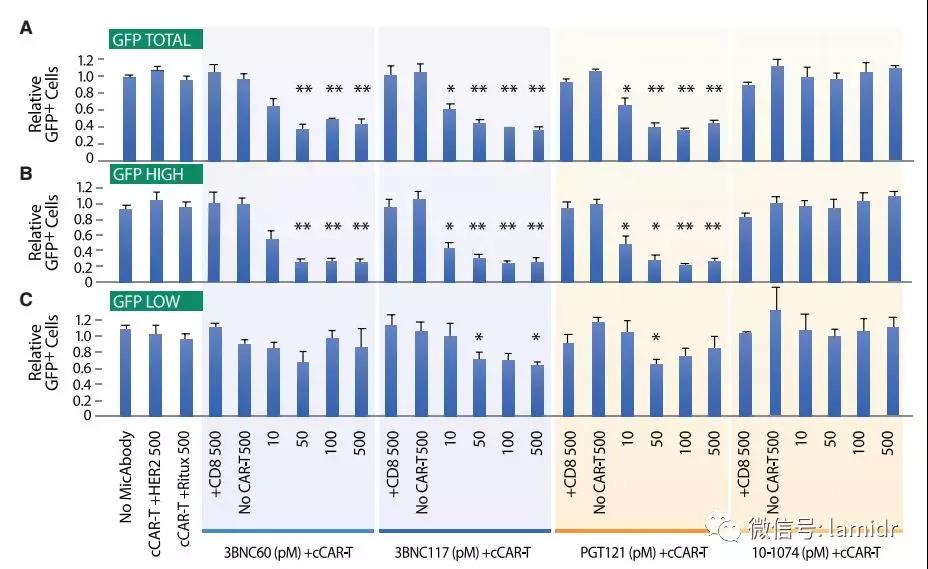
//靶细胞杀伤和HIV基因表达水平的关系//
虽然cCART能够对HIV感染细胞进行特异性杀伤,杀伤率始终保持在~65%。为了证实杀伤作用是否与感染细胞中病毒基因表达水平有关,采用荧光蛋白GFP表达水平定量测量HIV基因表达,结果发现高GFP水平的CD4+ T淋巴细胞容易被cCAR-T消灭(杀伤率达~90%)(图B),低GFP表达水平的杀伤率仅为~30%(图C),说明杀伤效率与HIV基因表达产物数量有关,可能与其在细胞表面表达的Env蛋白数量有关。
//cCAR-T对长期接受HAART治疗的感染者血液中再活化细胞的杀伤作用//
研究者比较了cCAR-T对扁桃体来源和活化血液来源的CD4+ T淋巴细胞的杀伤作用,发现两者作用相似。
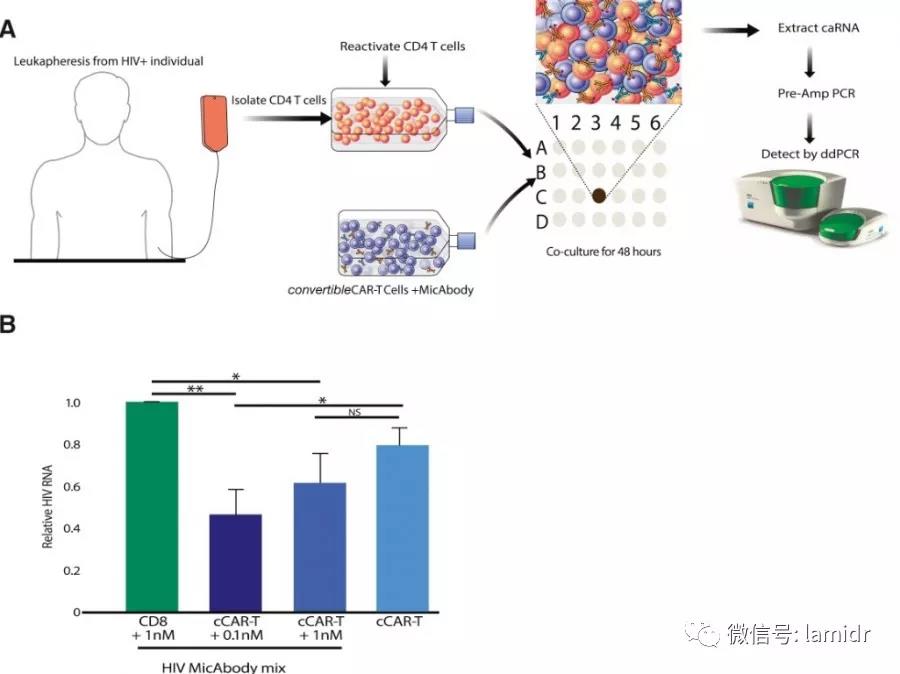
那么长期接受HAART的患者会有影响吗?
研究者选取了6名HIV阳性感染者个体血液中分离出CD4+ T淋巴细胞,与不同浓度的cCAR-T共培养。结果显示,低浓度(0.1nM)的杀伤效果优于1nM。说明cCAR-T疗法确实可以对潜伏的病毒库进行有效杀伤。
操作流程及结果


原创来源: 拉米医生 拉米Dr





